Couche électronique
En chimie et en physique atomique, une couche électronique d'un atome est l'ensemble des orbitales atomiques partageant un même nombre quantique principal n ; les orbitales partageant en plus un même nombre quantique azimutal ℓ forment une sous-couche électronique. Les termes couche et sous-couche sont hérités de la théorie des quanta du début du XXe siècle, et notamment des développements théoriques introduits par Arnold Sommerfeld autour du modèle de Bohr, qui expliquaient la structure fine des raies spectrales de l'atome d'hydrogène et des ions hydrogénoïdes par la quantification des niveaux d'énergie des électrons autour des noyaux atomiques en fonction de nombres quantiques.

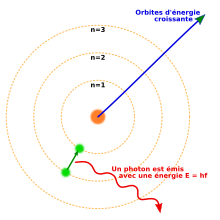
Les couches électroniques sont identifiées par leur nombre quantique n, valant 1, 2, 3, etc. ou, historiquement, par les lettres K, L, M, etc. utilisées en spectroscopie des rayons X[1]. Elles correspondent à une énergie croissante, qui se traduit par un éloignement croissant au noyau atomique. La couche K, pour laquelle n = 1, est la plus proche du noyau, et les couches L, M, N, O, P, Q et R correspondant à n = 2, 3, 4, 5, 6, 7 et 8, s'agencent par distance croissante au noyau de manière concentrique. Chaque couche électronique peut contenir un nombre maximum d'électrons égal à 2n2 : la couche K peut ainsi contenir jusqu'à 2 électrons, la couche L jusqu'à 8 électrons, la couche M jusqu'à 18 électrons, la couche N jusqu'à 32 électrons, la couche O jusqu'à 50 électrons, la couche P jusqu'à 72 électrons, la couche Q jusqu'à 98 électrons et la couche R jusqu’à 128 électrons[a].
Si le nombre n ne peut dépasser 7 pour les atomes à l'état fondamental, il peut prendre des valeurs bien plus élevées dans le cas d'atomes excités, comme c'est notamment le cas pour les atomes de Rydberg. Hormis pour les éléments de transition, la couche électronique la plus externe d'un atome est appelée couche de valence ; le nombre d'électrons qui l'occupent détermine les propriétés chimiques de l'atome : les éléments chimiques dont la couche de valence n'est occupée que par un électron — l'hydrogène et les métaux alcalins — sont les plus réactifs, tandis que ceux dont la couche de valence est saturée d'électrons — les gaz nobles — tendent à être chimiquement inertes.
Les couches électroniques, définies par le nombre n, ne permettent pas à elles seules de rendre compte des observations spectroscopiques. Outre le nombre ℓ azimutal, qui permet de distinguer les sous-couches électroniques, les électrons sont également définis par le nombre quantique magnétique mℓ et le nombre quantique magnétique de spin ms. Ces quatre nombres quantiques (n, ℓ, mℓ, ms) permettent de modéliser la configuration électronique des atomes électriquement neutres à l'état fondamental au moyen de la règle de Klechkowski, de la première règle de Hund et du principe d'exclusion de Pauli ; la distribution des électrons par couches électroniques des éléments chimiques à l'état fondamental est ainsi la suivante :
Élément chimique Famille d'éléments Électrons par couche[2] Ligne Colonne (groupe) 1 H Hydrogène Non-métal 1 1 I A 2 He Hélium Gaz noble 2 1 O 3 Li Lithium Métal alcalin 2, 1 2 I A 4 Be Béryllium Métal alcalino-terreux 2, 2 2 II A 5 B Bore Métalloïde 2, 3 2 III B 6 C Carbone Non-métal 2, 4 2 IV B 7 N Azote Non-métal 2, 5 2 V B 8 O Oxygène Non-métal 2, 6 2 VI B 9 F Fluor Halogène 2, 7 2 VII B 10 Ne Néon Gaz noble 2, 8 2 O 11 Na Sodium Métal alcalin 2, 8, 1 3 I A 12 Mg Magnésium Métal alcalino-terreux 2, 8, 2 3 II A 13 Al Aluminium Métal pauvre 2, 8, 3 3 III B 14 Si Silicium Métalloïde 2, 8, 4 3 IV B 15 P Phosphore Non-métal 2, 8, 5 3 V B 16 S Soufre Non-métal 2, 8, 6 3 VI B 17 Cl Chlore Halogène 2, 8, 7 3 VII B 18 Ar Argon Gaz noble 2, 8, 8 3 O 19 K Potassium Métal alcalin 2, 8, 8, 1 4 I A 20 Ca Calcium Métal alcalino-terreux 2, 8, 8, 2 4 II A 21 Sc Scandium Métal de transition 2, 8, 9, 2 4 III A 22 Ti Titane Métal de transition 2, 8, 10, 2 4 IV A 23 V Vanadium Métal de transition 2, 8, 11, 2 4 V A 24 Cr Chrome Métal de transition 2, 8, 13, 1 4 VI A 25 Mn Manganèse Métal de transition 2, 8, 13, 2 4 VII A 26 Fe Fer Métal de transition 2, 8, 14, 2 4 VII 27 Co Cobalt Métal de transition 2, 8, 15, 2 4 VII 28 Ni Nickel Métal de transition 2, 8, 16, 2 ou 2, 8, 17, 1[b] 4 VII 29 Cu Cuivre Métal de transition 2, 8, 18, 1 4 I B 30 Zn Zinc Métal pauvre 2, 8, 18, 2 4 II B 31 Ga Gallium Métal pauvre 2, 8, 18, 3 4 III B 32 Ge Germanium Métalloïde 2, 8, 18, 4 4 IV B 33 As Arsenic Métalloïde 2, 8, 18, 5 4 V B 34 Se Sélénium Non-métal 2, 8, 18, 6 4 VI B 35 Br Brome Halogène 2, 8, 18, 7 4 VII B 36 Kr Krypton Gaz noble 2, 8, 18, 8 4 O 37 Rb Rubidium Métal alcalin 2, 8, 18, 8, 1 5 I A 38 Sr Strontium Métal alcalino-terreux 2, 8, 18, 8, 2 39 Y Yttrium Métal de transition 2, 8, 18, 9, 2 40 Zr Zirconium Métal de transition 2, 8, 18, 10, 2 41 Nb Niobium Métal de transition 2, 8, 18, 12, 1 42 Mo Molybdène Métal de transition 2, 8, 18, 13, 1 43 Tc Technétium Métal de transition 2, 8, 18, 13, 2 44 Ru Ruthénium Métal de transition 2, 8, 18, 15, 1 45 Rh Rhodium Métal de transition 2, 8, 18, 16, 1 46 Pd Palladium Métal de transition 2, 8, 18, 18 47 Ag Argent Métal de transition 2, 8, 18, 18, 1 48 Cd Cadmium Métal pauvre 2, 8, 18, 18, 2 49 In Indium Métal pauvre 2, 8, 18, 18, 3 50 Sn Étain Métal pauvre 2, 8, 18, 18, 4 51 Sb Antimoine Métalloïde 2, 8, 18, 18, 5 52 Te Tellure Métalloïde 2, 8, 18, 18, 6 53 I Iode Halogène 2, 8, 18, 18, 7 54 Xe Xénon Gaz noble 2, 8, 18, 18, 8 55 Cs Césium Métal alcalin 2, 8, 18, 18, 8, 1 56 Ba Baryum Métal alcalino-terreux 2, 8, 18, 18, 8, 2 57 La Lanthane Lanthanide 2, 8, 18, 18, 9, 2 58 Ce Cérium Lanthanide 2, 8, 18, 19, 9, 2 59 Pr Praséodyme Lanthanide 2, 8, 18, 21, 8, 2 60 Nd Néodyme Lanthanide 2, 8, 18, 22, 8, 2 61 Pm Prométhium Lanthanide 2, 8, 18, 23, 8, 2 62 Sm Samarium Lanthanide 2, 8, 18, 24, 8, 2 63 Eu Europium Lanthanide 2, 8, 18, 25, 8, 2 64 Gd Gadolinium Lanthanide 2, 8, 18, 25, 9, 2 65 Tb Terbium Lanthanide 2, 8, 18, 27, 8, 2 66 Dy Dysprosium Lanthanide 2, 8, 18, 28, 8, 2 67 Ho Holmium Lanthanide 2, 8, 18, 29, 8, 2 68 Er Erbium Lanthanide 2, 8, 18, 30, 8, 2 69 Tm Thulium Lanthanide 2, 8, 18, 31, 8, 2 70 Yb Ytterbium Lanthanide 2, 8, 18, 32, 8, 2 71 Lu Lutécium Lanthanide 2, 8, 18, 32, 9, 2 72 Hf Hafnium Métal de transition 2, 8, 18, 32, 10, 2 73 Ta Tantale Métal de transition 2, 8, 18, 32, 11, 2 74 W Tungstène Métal de transition 2, 8, 18, 32, 12, 2 75 Re Rhénium Métal de transition 2, 8, 18, 32, 13, 2 76 Os Osmium Métal de transition 2, 8, 18, 32, 14, 2 77 Ir Iridium Métal de transition 2, 8, 18, 32, 15, 2 78 Pt Platine Métal de transition 2, 8, 18, 32, 17, 1 79 Au Or Métal de transition 2, 8, 18, 32, 18, 1 80 Hg Mercure Métal pauvre 2, 8, 18, 32, 18, 2 81 Tl Thallium Métal pauvre 2, 8, 18, 32, 18, 3 82 Pb Plomb Métal pauvre 2, 8, 18, 32, 18, 4 83 Bi Bismuth Métal pauvre 2, 8, 18, 32, 18, 5 84 Po Polonium Métal pauvre 2, 8, 18, 32, 18, 6 85 At Astate Métalloïde 2, 8, 18, 32, 18, 7 86 Rn Radon Gaz noble 2, 8, 18, 32, 18, 8 87 Fr Francium Métal alcalin 2, 8, 18, 32, 18, 8, 1 88 Ra Radium Métal alcalino-terreux 2, 8, 18, 32, 18, 8, 2 89 Ac Actinium Actinide 2, 8, 18, 32, 18, 9, 2 90 Th Thorium Actinide 2, 8, 18, 32, 18, 10, 2 91 Pa Protactinium Actinide 2, 8, 18, 32, 20, 9, 2 92 U Uranium Actinide 2, 8, 18, 32, 21, 9, 2 93 Np Neptunium Actinide 2, 8, 18, 32, 22, 9, 2 94 Pu Plutonium Actinide 2, 8, 18, 32, 24, 8, 2 95 Am Américium Actinide 2, 8, 18, 32, 25, 8, 2 96 Cm Curium Actinide 2, 8, 18, 32, 25, 9, 2 97 Bk Berkélium Actinide 2, 8, 18, 32, 27, 8, 2 98 Cf Californium Actinide 2, 8, 18, 32, 28, 8, 2 99 Es Einsteinium Actinide 2, 8, 18, 32, 29, 8, 2 100 Fm Fermium Actinide 2, 8, 18, 32, 30, 8, 2 101 Md Mendélévium Actinide 2, 8, 18, 32, 31, 8, 2 102 No Nobélium Actinide 2, 8, 18, 32, 32, 8, 2 103 Lr Lawrencium Actinide 2, 8, 18, 32, 32, 8, 3 104 Rf Rutherfordium Métal de transition 2, 8, 18, 32, 32, 10, 2 105 Db Dubnium Métal de transition 2, 8, 18, 32, 32, 11, 2 106 Sg Seaborgium Métal de transition 2, 8, 18, 32, 32, 12, 2 107 Bh Bohrium Métal de transition 2, 8, 18, 32, 32, 13, 2 108 Hs Hassium Métal de transition 2, 8, 18, 32, 32, 14, 2 109 Mt Meitnerium Indéterminée 2, 8, 18, 32, 32, 15, 2 110 Ds Darmstadtium Indéterminée 2, 8, 18, 32, 32, 16, 2 111 Rg Roentgenium Indéterminée 2, 8, 18, 32, 32, 17, 2 112 Cn Copernicium Métal de transition 2, 8, 18, 32, 32, 18, 2 113 Nh Nihonium Indéterminée 2, 8, 18, 32, 32, 18, 3 114 Fl Flérovium Indéterminée 2, 8, 18, 32, 32, 18, 4 115 Mc Moscovium Indéterminée 2, 8, 18, 32, 32, 18, 5 116 Lv Livermorium Indéterminée 2, 8, 18, 32, 32, 18, 6 117 Ts Tennesse Indéterminée 2, 8, 18, 32, 32, 18, 7 118 Og Oganesson Indéterminée 2, 8, 18, 32, 32, 18, 8
Notes et références modifier
Notes modifier
- Les couches O, P et Q ne sont jamais totalement remplies. L'oganesson par exemple, l'élément connu de numéro atomique le plus élevé (Z = 118), ne comporte que 32 électrons sur la couche O, 18 sur la couche P et 8 sur la couche Q.
- Le cas du nickel est ambigu car il présente deux configurations électroniques d'énergies suffisamment proches pour se recouvrir : l'énergie la plus faible de la configuration régulière [Ar] 3d8 4s2 est inférieure à l'énergie la plus faible de la configuration irrégulière [Ar] 3d9 4s1, de sorte qu'elle est souvent retenue dans les manuels, d'autant qu'elle est étayée par les données expérimentales ; c'est cependant la configuration irrégulière qui présente l'énergie moyenne la plus faible des deux, de sorte qu'elle est également retenue pour les calculs sur le nickel.
Références modifier
- Jean-Christophe Pain, « Fluorescence X et dénomination K, L, M... des couches électroniques », Bulletin de l'union des physiciens, vol. 112, no 1008, , p. 1161-1167 (lire en ligne)
- (en) CRC Handbook of Chemistry and Physics, section 1 : Basic Constants, Units, and Conversion Factors, sous-section : Electron Configuration of Neutral Atoms in the Ground State, 84e édition en ligne, CRC Press, Boca Raton, Floride, 2003.
