Ізотопи оксигену
| Поширеність ізотопів кисню | |
|---|---|
| 16O | 99.76% |
| 17O | 0.04% |
| 18O | 0.20% |
Ізото́пи ки́сню — атоми кисню (оксигену) з різною чисельністю нейтронів у ядрах. Відомо 18 ізотопів кисню, з них три — стабільних: 16O, 17O, 18O. Решта 15 — від 11O до 28O —— радіоактивні та мають період напіврозпаду менше 123 секунд.[1]
Кисень-16 є третім за поширеністю ізотопом у Всесвіті, поступається лише 1H та 4He.[2]На Землі частка 16O з-поміж ізотопів кисню становить 99,76%, внаслідок цього атомна маса кисню усереднено становить 15.9994 а.о.м.. В окремих середовищах, внаслідок температурних змін, тощо вона коливається в проміжку 15.99903—15.99977 а.о.м..[3]
Стабільні ізотопи ред.
У природі існує три стабільних ізотопи кисню: 16O, 17O, 18O. [4]
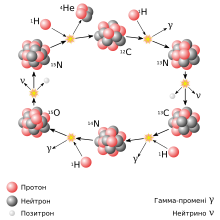
Кисень-16 є другим після гелію-4 найрозповсюдженішим ізотопом з поміж продуктів зоряного нуклеосинтезу. Та утворюється після потрійної альфа реакції: [2]
4He + 4He → 8Be (−0.0918 MeV) Злиттям двох ядер гелію-4 виникає нестабільний берилій-8. 8Be + 4He → 12C + 2γ||(+7.367 MeV)|| Якщо берилій-8 встигає провзаємодіяти з ядром гелію-4, утворюється вуглець-12. 12C + 4He → 16O + γ ||(+7.162 MeV)|| вуглець-12 поглинанням ядра гелію-4 у свою чергу продукує кисень-16.
У свою чергу два ядра кисню-16, в надрах масивних зір при температурах від 1500000000 K, можуть зливатися в ядра важчих елементів. Внаслідок цієї реакції ядерного горіння кисню утворюються різноманітні ізотопи, як масивніші (24Mg, 27Al, 28Si, 30P, 31P, 30S, 31S, 32S) так і легші (1H, 2H, 4He).
Співвідношення ізотопів ред.
1935 року було виявлено, що співвідношення R= 18O16O в атмосфері Землі є вищим аніж у морській воді. Явище отримало назву ефект Доула[en] на честь американського хіміка. Станом на 2005 рік співвідношення δ було виміряне: R(атмосфери)R(океану)-1=23.88‰. Цей дисбаланс виникає через мас-залежне фракціонування ізотопів хімічних елементів живими організмами (при диханні чи фотосинтезі). Також важка вода (молекули з важчими ізотопами кисню чи водню) слабше випаровується з водойм при нижчих температурах. Аналізуючи співвідношення δ= R(зразок)R(стандарт)-1 можна оцінити температуру клімату планети на момент формування зразка, наприклад, вмерзання повітряної бульбашки в кригу. Порівняння ізотопного складу кисню для вкраплень повітря в крижаних кернах льодовиків із сучасними значеннями (наприклад Віденський стандарт середньої океанічної води[en]) дозволяє палеоекології встановлювати хронологію кліматичних змін.[4]
Радіонукліди ред.
Окрім трьох стабільних ізотопів кисню, було штучно синтезовано ще 15, усі вони короткоживучі. Найдовше існує 15O — період напіврозпаду 122.24±0.16 c. Найкоротше 25O — 2.8±0.5.× 10^-21 с.[1]
- Ізотопи з меншою кількістю нейронів (11O—15O) головно за рахунок бета-розпаду з випромінюванням позитрона (β+) перетворюються на вуглець чи азот.
- Ізотопи з більшою кількістю нейронів (19O—28O) зазвичай через бета-розпад з випускання електрона (β-), перетворюються на флуор.
Кисень-15 ред.
Кисень-15 є однією з проміжних ланок вуглецево-азотного циклу (CNO-циклу), в якому чотири ядра протію (1H) перетворюються на ядро гелію-4 (4He). Цикл відіграє важливу роль в зоряному нуклеосинтезі.
Цей радіонуклід застосовується в медицині для позитронно-емісійної томографії (PET-візуалізація). 15O розпадається, випромінюючи позитрон, який у свою чергу анігілює з електроном з емісією двох гамма-квантів (з енергіями по ~511 кеВ). Аналіз розподілу гамма-квантів і використовується при обстеженні легень, центральної та периферійної гемодинаміки тощо. Щоправда через короткий час існування (період напіврозпаду — близько 2 хвилин), частіше застосовують інші ізотопи (11C, 13N, 18F).
В умовах земної атмосфери кисень-15 утворюється зокрема внаслідок впливу гамма-променів, що виникають зокрема від блискавок, на стабільний ізотоп 16O в молекулах кисню O2.[5]
Упродовж кількох хвилин після утворення майже весь кисень-15 перетворюється на стабільний азот-15:
15O → 15N + ν + e+
Гамма-промені, що утворюються внаслідок анігіляції позитрона, пролітають в середньому до 90 м в атмосфері.
Список ізотопів кисню ред.
| Символ нукліду | Z(p) | N(n) | Маса ізотопу (а.од.м.) | Період напіврозпаду (T1/2) | Канал розпаду (ймовірність) | Похідні ізотопи | Спін і Парність ядра |
|---|---|---|---|---|---|---|---|
| Енергія збудження | |||||||
| 11O | 8 | 3 | 11.0(1) | [~3.4 MeV] | 2p | 9C | 3/2−, 5/2+ |
| 12O | 8 | 4 | 12.034262(26) | > 6.3× 10^-21 c | 2p (60%) p (40%) | 10C 11N | 0+ |
| 13O | 8 | 5 | 13.024815(10) | 8.58(5)× 10^-3 c | β+ (89.1%) β+p (10.9%) | 13N 12C* | (3/2−) |
| 14O | 8 | 6 | 14.008596706(27) | 70.621(14) c | β+ | 14N* | 0+ |
| 15O | 8 | 7 | 15.0030656(5) | 122.24(16) с | β+ | 15N* | 1/2− |
| 16O* | 8 | 8 | 15.99491461960(17) | стабільний | — | — | 0+ |
| 17O* | 8 | 9 | 16.9991317566(7) | стабільний | — | — | 5/2+ |
| 18O* | 8 | 10 | 17.9991596128(8) | стабільний | — | — | 0+ |
| 19O | 8 | 11 | 19.0035780(28) | 26.464(9) с | β− | 19F* | 5/2+ |
| 20O | 8 | 12 | 20.0040754(9) | 13.51(5) с | β− | 20F | 0+ |
| 21O | 8 | 13 | 21.008655(13) | 3.42(10) с | β− | 21F | (5/2+) |
| 22O | 8 | 14 | 22.00997(6) | 2.25(9) с | β− (78%) β−n (22%) | 22F 21F | 0+ |
| 23O | 8 | 15 | 23.01570(13) | 9.7(8)× 10^-2 c | β− (93%) β−n (7%) | 23F 22F | 1/2+ |
| 24O | 8 | 16 | 24.01986(18) | 6.5(5)× 10^-2 c | β− (57%) β−n (43%) | 24F 23F | 0+ |
| 25O | 8 | 17 | 25.02934(18) | 2.8(5)× 10^-21 c | n | 24O | 3/2+# |
| 26O | 8 | 18 | 26.03721(18) | 9.0× 10^-21 c | 2n | 24O | 0+ |
| 27O | 8 | 19 | 27.04772(54) | <2.6× 10^-7 c | n (?) 2n (?) | ? | 3/2+# |
| 28O | 8 | 20 | 28.05591(75) | <1.00× 10^-7 c | n (?) 2n (?) | ? | 0+ |
| () — ± щодо останніх вказаних порядків значень; * — стабільні ізотопи;? — невідомо; # — розрахункові дані; (β) — бета-розпад (β− — електрон; β+ — позитрон); p — протонний розпад ; n — випромінювання нейтрона; | |||||||
Дивись також ред.
Джерела ред.
- ↑ а б в Таблиця ізотопів ((англ.)) . Корейський Дослідний Інститут Атомної Енергії[en]. Архів оригіналу за 21 жовтня 2019. Процитовано 21 вересня 2019.
- ↑ а б Arnett, David (1996). Supernovae and Nucleosynthesis ((англ.)) (вид. First). Princeton, New Jersey: Princeton University Press. с. 11. ISBN 0-691-01147-8. OCLC 33162440.
- ↑ Webb, T. B. та ін. (2019). First Observation of Unbound 11O, the Mirror of the Halo Nucleus 11Li. Physical Review Letters ((англ.)) . 122 (12): 122501-1—122501-7. arXiv:1812.08880. doi:10.1103/PhysRevLett.122.122501.
- ↑ а б Кундельчук О.П. (2016). Палеоекологія (навчальний посібник) (PDF) ((укр.)) . Херсонський державний університет,. Процитовано 22 вересня 2019.[недоступне посилання]
- ↑ Timmer, John (25 листопада 2017). Lightning strikes leave behind a radioactive cloud. Ars Technica ((англ.)) . Архів оригіналу за 10 лютого 2022. Процитовано 28 вересня 2019.