Enlace carbono-oxígeno
Un enlace carbono-oxígeno es un enlace covalente entre un átomo de carbono y otro de oxígeno y es uno de los más abundantes en química orgánica y bioquímica.[1] En el contexto de la regla del octeto,el oxígeno tiene 6 electrones de valencia y necesita compartir dos de sus electrones uniéndose o enlazándose a otro átomo —como el carbono— dejando los restantes 4 electrones no-enlazantes en 2 pares no compartidos. Un ejemplo simple de este tipo de enlace es el etanol, o alcohol etílico, con un enlace carbono-oxígeno y un enlace carbono-hidrógeno.

Enlace simple carbono-oxígeno editar
Un enlace C-O está fuertemente polarizado hacia el oxígeno (electronegatividad C vs O = 2.55:3.44). Muchos alcoholes son solubles en agua por esta polaridad y por la formación de enlaces de hidrógeno. La longitud de enlace para los enlaces simples C-O tiene un valor aproximado de 143 picometros, menor que la longitud de los enlaces C-N o C-C. Un enlace simple acortado se encuentra en los ácidos carboxílicos (136 pm) debido al carácter de doble enlace parcial; un enlace alargado se encuentra en los epóxidos (147 pm).[2] La energía de enlace C-O es también mayor que la de los enlaces C-N o C-C. Por ejemplo, las energías de enlace son de 91 kcal/mol (a 298 K) en el metanol, 87 kcal/mol en metilamina, y de 88 kcal/mol en etano.
Enlace doble carbono-oxígeno editar
Carbono y oxígeno forman enlace doble terminal C=O llamado grupo carbonilo en grupos funcionales como cetonas, ésteres, ácidos carboxílicos y muchos más. También se encuentran enlaces C=O internos en iones oxonio, cargados positivamente, pero sobre todo aparece en compuestos intermediarios de reacción. En los furanos, el átomo de oxígeno contribuye a la deslocalización de los electrones π gracias a su orbital p lleno, de ahí que los furanos sean compuestos aromáticos. Las longitudes de los enlaces C=O son de aproximadamente 123 pm en los compuestos carbonilo. La longitud de enlace C=O en los haluros de acilos tiene carácter parcial de triple enlace y consecuentemente es más corto: 117 pm. Los enlaces dobles C=O también tiene energías muy altas, incluso mayores que la del triple enlace N-N.[3]
No existen compuestos con triple enlace formal C-O, más allá del monóxido de carbono.
Química de los enlaces C-O y C=O editar
En química orgánica, la reactividad de los enlaces carbono-oxígeno se deriva de la carga parcial positiva que induce el oxígeno en el carbono, frente a enlaces menos polares C-C o C-H, de la carga parcial negativa que reside en el oxígeno, y de la posibilidad de cambiar el carácter enlace entre simple y doble, o bien de rotura heterolítica del enlace simple, ya que el oxígeno en general puede estabilizar una carga negativa. Algunas reacciones importantes en las que aparecen compuestos con enlaces carbono-oxígeno son:
- La síntesis de éteres de Williamson,
- La sustitución nucleofílica al grupo acilo y
- La adición electrofílica a alquenos.
- La reacción de Paterno-Buchi es el equivalente de una reacción de metátesis con el grupo carbonilo .
Grupos funcionales que contienen oxígeno editar
Los enlaces carbono-oxígeno están presentes en estos grupos funcionales:
| Serie homóloga | Orden de enlace | Fórmula | Fórmula estructural | Ejemplo |
|---|---|---|---|---|
| Ácidos carboxílicos | 1+2 | RCOOH | 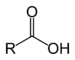 |  Ácido acético |
| Alcoholes | 1 | R3C-OH |  |  Etanol |
| Éteres | 1 | R3C-O-CR3 |  |  Dietiléter |
| Peróxidos | 1 | R3C-O-O-CR3 |  |  Peróxido de diterbutilo |
| Ésteres | 1+2 | R3C-CO-O-CR3 |  |  Acrilato de etilo |
| Ésteres carbónicos | 1 | R3C-O-CO-O-CR3 |  |  Carbonato de etileno |
| Cetonas | 2 | R3C-CO-CR3 |  |  Acetona |
| Aldehídos | 2 | R3C-CHO |  |  Acroleína |
| Furanos | 1.5 |  |  Furfural | |
| Sales de pirilio | 1.5 |  |  Antocianinas |
Principales moléculas inorgánicas con enlace carbono-oxígeno editar
Fuera de la química orgánica también hay moléculas importantes con enlace carbono-oxígeno, como son:
- el dióxido de carbono, protagonista del ciclo del carbono, fundamental para la vida, su producto de equilibrio con el agua, el ácido carbónico, y sus productos de desprotonación, el anión bicarbonato y el anión carbonato,
- el monóxido de carbono, de gran relevancia práctica por su toxicidad y su generación como subproducto en muchos procesos de combustión, y que también tiene aplicaciones en química de coordinación, donde típicamente estabiliza metales en estados bajos de oxidación,
- los aniones acetato y oxalato, aunque estrictamente se pueden considerar orgánicos por ser ácidos carboxílico, son muy relevantes para la química inorgánica donde se usan como ligandos de diversa denticidad,
- los productos de oxidación parcial de grafenos, fullerenos y nanotubos de carbono.
Véase también editar
- La química de los átomos de carbono unidos a los otros elementos de la Tabla Periódica:
Enlaces químicos del carbono con el resto de átomos editar
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. | Enlace desconocido / no evaluado. |
Referencias editar
- ↑ Organic Chemistry John McMurry 2nd Ed.
- ↑ CRC Handbook of Chemistry and Physics 65Th Ed.
- ↑ Standard Bond Energies Archivado el 21 de noviembre de 2016 en Wayback Machine., Department of Chemistry, Michigan State University
